时代财经APP
企业第一财经读本

争入场券 一致性评价搅动千亿化药注射剂市场
随着一致性评价的推进,意味着未来的药品带量采购将会把过评化药注射剂包含其中,大部分市场将会被率先过评的药品占据,行业集中度也会随之提升。
化药注射剂市场将迎来新一轮洗牌。
 图源:视觉中国
图源:视觉中国
5月14日,国家药监局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告(2020年第62号)》(以下简称“《公告》”)。这意味着时隔两年,关于化药注射剂一致性评价工作目前正式落地。
 图源:药监局官网
图源:药监局官网
要知道,仿制药一致性评价是带量集中采购的“入场券”,药企要实现集采放量,产品越早通过评价越能抢占先机,目前,科伦药业(SZ:002422)、恒瑞医药(SH:600276)等企业已纷纷入局。
北京鼎臣医药管理咨询中心创始人史立臣5月15日对时代财经表示,“化药注射剂一致性评价的开展是为了进一步提升行业整体产品质量。在这个过程中,化药注射剂市场也将迎来新一轮重构和洗牌。”
一致性评价不断推进
注射剂一致性评价一直是行业关注的焦点,近年来,相关文件也在加紧推进。
早在2017年12月,药审中心就发布了《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,对参比制剂的选择、处方工艺技术要求、质量研究与控制技术要求等提出意见。不过正式稿一直未正式发出。
海通证券5月15日分析称,注射剂一致性评价经过多番讨论,时隔两年,在去年10月有实质性进展,再到目前正式落地,意味着业内已达成共识,后续一致性工作将逐步开展。
此次,国家药监局明确了需要开展化药注射剂一致性评价的对象。《公告》指出,已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。
尚未收载入《仿制药参比制剂目录》的品种,药品上市许可持有人应当按照《国家药监局关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)规定申报参比制剂,待参比制剂确定后开展一致性评价研发申报,避免出现因参比制剂选择与国家公布的参比制剂不符,影响研究项目开展、造成资源浪费等问题。
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物。
史立臣表示:“例如备受关注的化药注射剂的不良反应问题,事实上原研药自身也存在不良反应,但仿制药要将不良反应控制在与原研药一致的范围之内。”
国家药监局在政策解读时提到,对临床价值明确但无法确定参比制剂的化学药品注射剂仿制药,如氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水等,无需开展一致性评价。
这也意味着,绝大多数化学仿制药注射剂都要开展一致性评价工作,对国内注射剂产业影响巨大。
值得注意的是,在审评时限要求上,国家药监局还表示,依据《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号),审评工作应当在受理后120日内完成。经审评认为需申请人补充资料的,申请人应在4个月内一次性完成补充资料。发补时限不计入审评时限。
不过,史立臣表示,“目前来看,国内能够开展一致性评价的科室太少了,这直接导致药企进行一款药物一致性评价的费用非常高,此前口服制剂一致性评价的价格就已经达到800—1000万元,而且很多药企口服制剂的一致性评价都还没有做完。”
5月15日,时代财经从国内某家药企管理人员处解到,目前市场上单品种注射剂一致性评价费用约在300万元。尽管价格不菲,但该管理人员表示:“这是药品的必经之路,只有通过一致性评价才有资格参与后续的带量采购,如果错失带量采购,就失去了国内的大半市场。”
企业纷纷入局一致性评价
米内网数据显示,2018年中国公立医疗机构终端化学药和中成药的注射剂合计销售额达6920亿元,其中,化药注射剂占比超过85%,达到5882亿的销售规模。
由此可见,面对近六千亿市场的诱惑以及后续带量采购的推荐,注射剂一致性评价已成为各企业必争的领域,但目前化药注射剂的过评情况并不乐观。
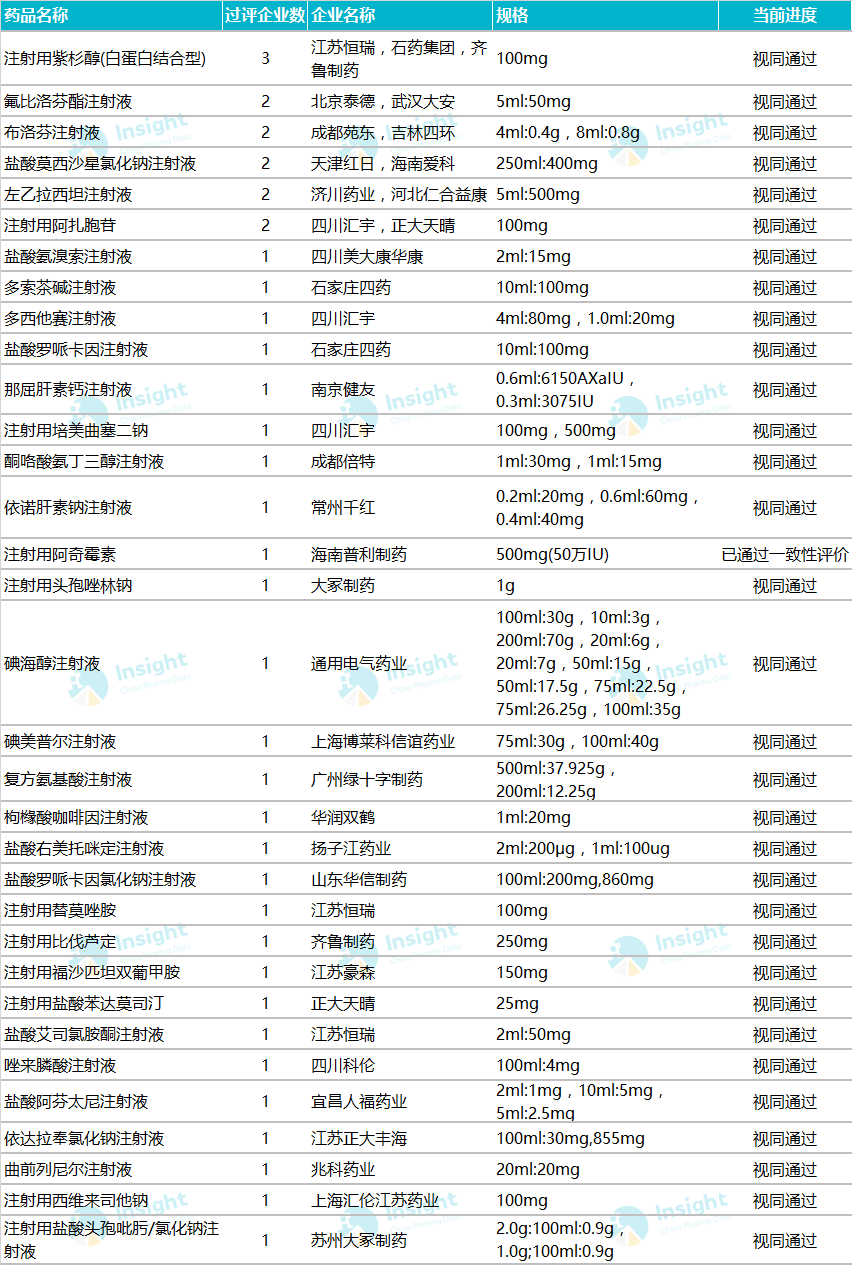
据Insight数据库统计,截至2020年4月17日,已有255个品种通过/视同通过仿制药一致性评价,其中只有33个品种是注射剂。
 图源:Insight数据库
图源:Insight数据库
史立臣对时代财经表示,化药注射剂整体一致性评价标准相比口服制剂要高很多,在质量监管、临床应用等数据要求也非常严格。“例如化药注射剂生产环境主要是无菌车间,要求高、成本高,这也使得化药注射剂过评难度较大,过评产品数量较少。”
时代财经注意到,目前153 个注射剂品种已经有企业递交一致性评价补充申请,其中,盐酸氨溴索注射液、注射用头孢曲松钠、注射用奥美拉唑钠、注射用帕瑞昔布钠、注射用头孢他啶有超过 10 家企业递交补充申请,成为注射剂一致性评价里最热门的品种。
其中,科伦药业是目前注射剂一致性评价申报数量最多的公司,申报注射剂品种涵盖抗感染、肠外营养及呼吸系统等,其中盐酸氨溴索注射液是市场规模超过50亿的大品种,该公司评审进度排名第三。除科伦药业外,恒瑞医药、人福医药和福安药业申报评审的产品数量都在10个以上。
对于企业参与一致性评价工作,史立臣建议,如果企业并未掌握该注射剂产品的原料药生产,没有必要参与一致性评价。“企业将药品再评价是为了拿到后续参与带量采购入场券,如果企业并没有掌握评价药品的原料药生产,就无法将药品价格降到最低,如果在后续带量采购的价格战中败下阵来,此前花大价钱进行的一致性评价也就没有了意义。”
日前,山西省已经率先开展了注射剂带量采购,涉及呼吸、血液、肿瘤、麻醉、神经等多个用药领域的21个品种,共计35个规格的药品。
“山西省带量采购采购结束后,其价格会直接全国联动。未来,化药注射剂在全国集采中会再经历一次价格战,企业最终拼的仍是价格。”史立臣说。

 时代财经
时代财经

